الرابطة المعدنية
في عملية تشكيل الرابطة الكيميائيةيتم إعادة توزيع الكثافة الإلكترونية ، التي كانت في الأصل تابعة لذرات مختلفة ، في الفضاء. التفاعل مع قلب الإلكترونات ذات المستوى الخارجي أقل استقرارًا. إنهم هم الذين يلعبون الدور الرئيسي في تكوين الروابط الكيميائية. تسمى الإلكترونات التي تشارك في هذه العملية إلكترونات التكافؤ. والرابطة الكيميائية نفسها هي التكافؤ. إن عناصر p و s هي إلكترونات خارجية ، حيث تحتوي عناصر d على آخر إلكترونات (d) خارجية (s) وما قبل الأخير d للإلكترونات. هناك ذرات أقل استقرارا أو أكثر. ويشمل الأخير هؤلاء الذين يحتوي مستواهم الخارجي على الحد الأقصى لعدد الإلكترونات (اثنان وثمانية). هذا المستوى يعتبر كامل. تتميز مستويات الانتهاء من قوة أكبر. وهي متلازمة في ذرات الغازات النبيلة ، وبالتالي فإن حالتها في ظل الظروف العادية هي غاز أحادي الذرة خامل.
لذرات العناصر الأخرى مميزةمستويات غير كاملة. في سياق التفاعل الكيميائي ، يتم الانتهاء من مستويات الأهمية الخارجية. يتم تحقيق ذلك إما عن طريق الارتداد أو عن طريق إرفاق الإلكترونات. يمكن الانتهاء من المستويات وتكوين أزواج مشتركة. تساهم هذه الطرق في تشكيل نوعين رئيسيين من الروابط: الأيونية والتساهمية. عندما يتم تكوين جزيء ، بالتالي ، تحاول الذرات الحصول على غلاف إلكتروني ثابت (خارجي): إما قذيفة ثمانية إلكترون أو قذيفة إلكترون. هذا الانتظام يكمن وراء نظرية تشكيل الروابط الكيميائية. ويرافق تشكيل التكافؤ من خلال استكمال المستوى الخارجي في الذرات المقابلة إطلاق كمية كبيرة من الطاقة. بعبارة أخرى ، دائمًا ما يتكوّن تكوين رابطة كيميائية طاردة للحرارة ، فيما يتعلق بمظهر الجزيئات (الجسيمات الجديدة) التي تتمتع باستقرار أكبر في الظروف العادية.
باعتبارها واحدة من المؤشرات الهامة ،الكهرومغناطيسية هي العامل الحاسم في الاتصال. هذه هي قدرة الذرة على جذب إلكترونات من ذرات أخرى. التغيير في الكهربية المفرطة هو تدريجي. وبالتالي ، تزداد قيمة هذا المؤشر في فترات النظام من اليسار إلى اليمين. الحد من نفس القيمة يحدث في مجموعات من أعلى إلى أسفل. تشتمل المركبات التساهمية على تشكيلات بسبب تكوين أزواج إلكترونات ملزمة (شائعة).
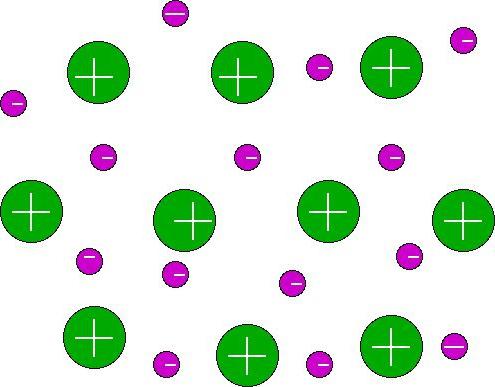
في السائل ، الحالة الصلبة في المعادن ، هناكالرابطة الكيميائية المعدنية. وفقاً للوضع في النظام الدوري ، تحتوي ذرات العناصر قيد النظر على عدد قليل من إلكترونات التكافؤ (واحد إلى ثلاثة). بالإضافة إلى ذلك ، لديهم طاقة منخفضة من "انفصال الإلكترون" (التأين). في هذا الصدد ، السند المعدني هو اتصال ضعيف نوعًا ما. يتم الإبقاء على الإلكترونات في الذرة ضعيفة ، فهي تنكسر بسهولة كافية ، بينما تكون قادرة على التحرك حول البلورة. يفترض الرابط المعدني وجود ذرات حرة. جزء من إلكترونات التكافؤ ، الموهوبة بالقدرة على التحرك بحرية داخل الشبكة البلورية ، تشكل "غاز الإلكترون". مع مساعدته ، يتم تشكيل السندات المعدنية. ينشأ ذلك بسبب "التنشئة الاجتماعية" لإلكترونات التكافؤ بواسطة الذرات. وتجدر الإشارة إلى أن السندات المعدنية لها خصائصها الخاصة. لذا ، فإن الإلكترونات التي تشكلها لها القدرة على التحرك في جميع أنحاء حجم العنصر. في هذا الصدد ، تحصل المعادن على عدد من السمات المميزة. على وجه الخصوص ، وتشمل هذه اللمعان ، الموصلية الكهربائية الجيدة ، التوصيل الحراري ، ليونة ، ليونة وغيرها. يوفر الرابطة المعدنية قدرة تخفيض عالية نسبياً في العناصر.