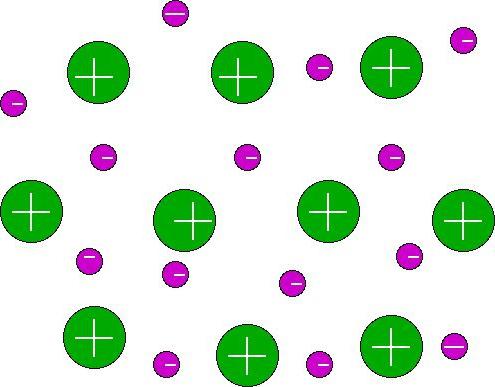
رابطة المتبرع بالتبرع: أمثلة على المواد
الارتباط بين الجهات المانحة أو التنسيق هو نوع من الروابط التساهمية. نكشف عن السمات المميزة لهذا النوع من الاتصال ، وسنقدم أمثلة توضح تشكيله.

رابطة تساهمية
في البداية ، نميز السمات المميزة للرابطة الكيميائية التساهمية نفسها.
يمكن أن يكون القطبية وغير القطبية ، فياعتمادا على موقف زوج الإلكترون بين الذرات. إذا حدث تحول جزئي لكثافة الإلكترون باتجاه واحدة من الذرات ، يحدث ارتباط كيميائي قطبي تساهمي. وهناك ظاهرة مشابهة ممكنة مع تكوين رابطة بين اللافلزات التي تحتوي على كهروضوية مختلفة. عندما يزداد ذلك ، يحدث تحول كبير في زوج الإلكترون نحو الذرة مع طبقة EO كبيرة. عندما يتشكل الرابطة بين اللافلزات ذات القيمة الكهرومغناقية نفسها ، لا يوجد تحول لزوج من الإلكترونات ، ويسمى هذا الاتصال nonpolar.
ومن الأمثلة على ذلك الأكسجين والهيدروجين والأوزون والفوسفور. الوصل القطبي هو حمض الهيدروكلوريك ، الماء ، الأمونيا.
هناك مصطلح خاص يمكن من خلاله وصف عدد أزواج الإلكترونات المتكونة بين الذرات.
النظر في ذلك لتشكيل رابطة واحدةيتطلب إلكترونين ، سيكون هناك ثلاثة روابط بين ذرات النيتروجين ، أي أن التعدد يتوافق مع ثلاثة. الترابط بين المتبرعين هو حالة خاصة من الرابطة القطبية التساهمية ، ولكن يفترض التفاعل بين الجزيئات من المواد.

ملامح الآلية
لتشكيل الرابطة التساهمية التقليديةتفاعل كاف بين إلكترونين (زوج مشترك). المانحين متقبل السندات التي شكلتها الكيميائية من خلال زوج من الإلكترونات من جانب واحد (من متبرع)، فارغ (مجانا) على المدار من ذرة أخرى (متقبل). في حالة الرابطة التساهمية القطبية (غير القطبية) وفي تفاعل المتلقي المانح ، تصبح الإلكترونات شائعة في النهاية.

تكوين الكاتيون الأمونيوم
كيف يتم تشكيل السند المتلقي المانحة؟ تقتصر أمثلة المواد الموجودة في سياق كيمياء المدرسة الثانوية على كاتيونات الأمونيوم. دعونا نحلل تعليمه بمزيد من التفصيل.
النيتروجين ، وهو جزء من جزيء الأمونيا ،في المجموعة الخامسة (المجموعة الفرعية الرئيسية) من الجدول الدوري. على مستوى الطاقة الخارجية ، هناك خمسة إلكترونات. في تكوين جزيئات الأمونيا في التساهمية الربط النيتروجين القطبي تنفق ثلاثة الإلكترونات، وبالتالي فإن الزوج الإلكترون، والتي لا تشارك في هذه العملية، لا تزال غير مستخدمة.
هي التي تعطيه الحق في إظهار خصائص المتبرع عندما تتحد جزيئات الأمونيا مع ثنائيات الماء. في الماء ، لا يحتوي كاتيون الهيدروجين على إلكترونات خاصة به ، لذا فإنه يعرض خصائص المستقبِل.
في وقت تكون فيه جزيئات الأمونيا علىقريبة من بروتونات الهيدروجين من الماء ، تظهر سحابة نيتروجين تتكون من إلكترونين في مجال جاذبية هيدروجين الموجب ، وتصبح شائعة بالنسبة لهم. ونتيجة لذلك ، يحدث تكوين رابطة رباعي التكافؤ بين النيتروجين والهيدروجين ، ومن المفترض وجود آلية متلقية للمانحين. هذا ، كما يقولون ، هو مثال كلاسيكي لتشكيل الاتصالات.
تشكيل الكاتيون Oxonium
في المناهج الدراسية (المستوى الأساسي) ، لاالنظر في الكاتيون oxonium (hydroxonium) ، حيث يتم دراسة نظرية الحلول البروتونية فقط على مستوى المظهر الجانبي. ونظرًا لاستخدام السندات المتوافقة مع المانحين هنا ، سيتم النظر في مزيد من التفاصيل عن تشكيله.
كجهة مانحة في هذه الحالة سوف تعملجزيء الماء ، والبروتون يتجلى خصائص المستقبِل. آلية المانحين المقبولة هي ما يسمى أساس كيمياء المركبات المعقدة ، وبالتالي فهي تستحق عناية خاصة. يشرح جوهر نظرية التحلل الكهربائي للأحماض والأملاح والقواعد عندما يذوب في الماء إلى الكاتيونات والأنيونات.
عندما يتم إجبار مثل هذا الاتصال ، يحدث اختراق الإلكترونات المربوطة في الغلاف الخارجي للذرات المرتبطة بها. في هذه الحالة ، هناك زيادة في عدد الإلكترونات على الأصداف الخارجية بمقدار واحد.
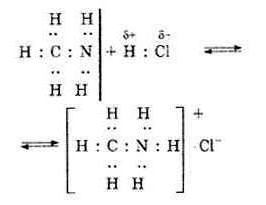
الخوارزمية الثانية لتشكيل الاتصالات
هناك آلية أخرى من خلالهاسند المتبرع المتبرع به. أمثلة على مثل هذه التفاعلات عديدة ، لا سيما تشكيل الفلوريدات المعدنية. لوحظ استخدام زوج من الإلكترونات لأحد الذرات المتفاعلة. ونتيجة لذلك ، تكمل ذرة واحدة قوقعتها إلى أقصى حد ، ولكن ليس كل الإلكترونات الثمانية تشارك في الاتصال ، فقط جزء معين منها. تُسمى هذه الإلكترونات التي لن تشارك في الاتصال بالحرية ، وبمساعدة الآخرين ، يتم إنشاء رابطة مستقبلة للمانحين. والأمثلة على مثل هذا النوع من السندات المتلقية للمانحين تتعلق بتكوين الفلورايد في الفلزات القلوية الأرضية والقلوية. على سبيل المثال ، يتم إعداد الصوديوم والبوتاسيوم والفلوريد الكالسيوم بالمثل.
ما هو الفرق بين السند المتلقي للجهة المانحة؟ من الممكن فصل المركبات الثابتة التي تنشأ بسبب آلية مشابهة لتشكيل المركبات الكيميائية. على سبيل المثال ، حل فلوريد الهيدروجين في الماء ، والاتصال بين الأمونيا وكلوريد الألومنيوم ، مما يؤدي إلى تشكيل مركبات معقدة.

استنتاج
مع مراعاة قواعد المتلقي المانحالتفاعل، علما بأن الغازات الخاملة قد تعمل بشكل جيد المانحين النشطة كما، لأن القشرة الخارجية لديها أكبر قدر ممكن من الإلكترونات. تجريبيا هذا البيان قد تم التحقق بشكل كامل وتحديد أكاسيد تتشكل الغازات الخاملة من التفاعلات المانحين متقبل.
هذا النوع من الرابطة التساهمية له علاقة خاصةقيمة في حياة الشخص. بالإضافة إلى المشاركة النشطة في حياته ، بفضل التواصل مع المتبرعين ، فإنه من الممكن إنشاء المنتجات الغذائية ، والمستحضرات الصيدلانية المختلفة. على سبيل المثال ، فإن آلية تكوين الكاتيونات الأمونية المذكورة أعلاه تتعلق بتكوين الأمونيا ، والتي تستخدم على نطاق واسع في الطب الحديث.